Inhaltsverzeichnis
Enteropathie
Eines der größten Probleme in der Haltung von Kaninchen stellt die Etablierung und Erhaltung ihrer Darmgesundheit dar. Im Vergleich zum Menschen vergeht beim Kaninchen die Zeit von der Geburt über das Aufwachsen hin zum erwachsenen Tier rasend schnell. Fehler in der Haltung und Fütterung, die sich über Tage oder Wochen hinziehen, sind nur noch selten zu korrigieren. Sie beginnen in der Regel schon vor der Geburt durch die Auswahl der Elterntiere und setzen sich fort durch ein falsches Verständnis für die Bedürfnisse der Tiere. Wenn man der aktuellen Literatur folgt, gewinnt man den Eindruck, dass seit 1997 eine neue Erkrankung in Kaninchenmast und -zuchtbeständen wie auch vereinzelt in Heimtierhaltungen Einzug gehalten hat, die früher „Mukoide Enteropathie“ und heute „Epizootic Rabbit Enteropathy“ (ERE) genannt wird.
Definitionen
Als „Krankheit“ werden Störungen der Lebensvorgänge in Organen oder im gesamten Organismus mit der Folge von subjektiv empfundenen bzw. objektiv feststellbaren körperlichen, geistigen bzw. seelischen Veränderungen verstanden. „Enter-“ ist ein Wortteil aus dem Griechischen mit der Bedeutung „Darm“ bzw. „Eingeweide“. Als „Enterocolitis“ wird eine Entzündung des Dünn- und Dickdarms bezeichnet, die am häufigsten durch bakterielle oder Virusinfektionen verursacht wird. Bei „Enteritis“ handelt es sich um eine Darmentzündung bzw. eine entzündliche Erkrankung des Dünndarms, die bei Mitbeteiligung des Magens „Gastroenteritis“ und bei einer Beteiligung des Dickdarms „Enterokolitis“ genannt wird. Mit „Enteropathie“ wird ganz allgemein eine Darmerkrankung bezeichnet (Pschyrembel, 2001). „Mukoid“ leitet sich aus dem griechischen Wort „Mucus“ für Schleim ab. Unter der „Ätiologie“ versteht man die Ursache der Erkrankung und unter „Pathogenese“ die Gesamtheit der Faktoren, die ursächlich zu einer bestehenden Krankheit geführt haben. Sind mehrere Ursachen für eine Krankheit ursächlich, spricht man auch von einer „multifaktoriellen“ Ätiologie.
Geschichte
1976 setzte sich Whitney in einem Artikel mit der „unspezifischen Enteritis“ beim Kaninchen auseinander und teilte sie in drei Klassen ein:
- Enteritis mit bekannter Ätiologie, einschließlich Kokzidiose, Helminthiasis (Wurmerkrankung), Salmonellose und infektiöse, diphteroide Enteritis.
- Enteritis mit unbekannter Ätiologie einschließlich Schleimhautentzündung, Typhlitis (Blinddarmentzündung), Impaktion (Verstopfung), sowie hämorrhagische und nicht-hämorrhagische Enteritis. Diese Erkrankungen wurden vom gleichen Autor, Whitney 1970, auch als „Enteritis-Komplex“ bezeichnet.
- Erkrankungen mit unsicherer Ätiologie, die eng mit dem Enteritis-Komplex verwandt sind, aber mit einer Infektion mit Clostridium perfringens oder Escherichia coli einhergehen.
Vermutet wurde, dass die Krankheiten des „Enteritis-Komplexes“ wahrscheinlich multifaktoriell verursacht sind.
Meshorer berichtete 19761) von Ausbrüchen einer „Mukoiden Enteritis“ in der konventionellen Zucht des Weizmann Institute of Science in Israel. Es wurde davon ausgegangen, dass das Vorhandensein großer Mengen von Escherichia coli (E. coli) im Darmtrakt von Kaninchen eine Voraussetzung für die Entwicklung der mukoiden Enteritis war. Nach Zugabe von Antibiotika im Futter (Pellets) der Tiere verschwand innerhalb von 3 Monaten nach Beginn der Behandlung die Erkrankung in der Kaninchenkolonie allmählich. Diese Technik wurde weitere 4 Jahre angewendet, ohne das ein einziger Fall von Mukoider Enteritis mehr auftrat.
1977 fanden Cantey & Blake2) den E. coli-Stamm „RDEC-l“ als ätiologisches Agens für Durchfallerkrankungen bei Kaninchen. Die klinische Erkrankung war der, durch enterotoxische E. coli beim Menschen in Bezug auf Inkubationszeit, Dauer der Diarrhöe und Abwesenheit von polymorphkernige Granulozyten im Kot recht ähnlich. Der Stamm RDEC-l ist hoch virulent, eine Schlussfolgerung, die durch die Tatsache gerechtfertigt war, dass bereits 150 Bakterien in der Lage waren, Durchfall zu produzieren.
1981 veröffentlichten Patton & Cheeke einen kurzen Warnhinweis („precautionary note“)3), der sich auf Empfehlungen des Rabbit Research Center der Ohio State University für höhere Rohfasergehalte in Futtermitteln bezog, um die Enterotoxämie (perakut verlaufende Vergiftungen im Darm durch Bakterien), eine der vielen Ursachen für Enteritis bei Kaninchen, zu bekämpfen. Die Autoren beschrieben Fälle, in denen Muttertiere als auch Jungtiere begannen, das Futter zu meiden, einen gallertartigen Stuhlgang zu entwickeln, große Mengen Wasser zu trinken und mit den Zähnen zu knirschen. Die Tiere starben innerhalb weniger Tage. Post-Mortem-Untersuchungen zeigten bei den meisten eine Verstopfung im Verdauungstrakt. Entweder hatten die Kaninchen ein sehr ballaststoffreiches Futter erhalten (22% und mehr) oder ein Futter mit einen mäßigen Ballaststoffgehalt (15-20%) und zusätzlich Heu, Stroh oder anderes, faserreiches Material. Kaninchenzüchter sollten bei einem Ausbruch von „Mukoider Enteritis“ deshalb sofort damit beginnen, den Fasergehalt in ihrem Kaninchenfutter zu untersuchen.
Lelkes & Chang, 19874) untersuchten den Blinddarminhalt von normalen Kaninchen und solchen, die an „Mukoider Enteropathie“ (ME) erkrankt waren. Kaninchen mit ME wiesen durchweg eine dramatische Zökaldysbiose auf, also eine Fehlbesiedelung des Blinddarms mit Bakterien. Zökale pH-Messungen bei normalen jungen und erwachsenen Kaninchen zeigten, dass die pH-Werte bei jungen Kaninchen grundsätzlich niedriger waren und häufig niedrig genug lagen, um mikrobielle Veränderungen zu induzieren.
Kötsche & Gottschalk lieferten 19905) recht umfangreiche Beschreibungen verschiedener Darmerkrankungen, über die mit der Schaffung größerer Kaninchenbestände im zunehmenden Maße insbesondere bei Jungtieren berichtet wurde. Unter „Infektiöse Magen-Darm-Entzündungen“ wurden diese „infektiösen Gastroenteritiden“ auf Grund des durch Durchfälle gekennzeichneten klinischen Bildes auch als „akute Dysenterien“ bezeichnet und folgendermaßen eingeteilt:
- infektiöse Magen-Darm-Entzündungen
- Mukoide Enteritis
- diphteroide Dünndarmentzündung
- diphteroid-nekrotisierende Typhlitis (Tyzzersche Krankheit)
- Clostridien-Enterotoxämie.
Als weitere zählten Rodentiose, Salmonellose, Rotavirusinfektion, Chlamydienenteritis sowie Campylobacterinfektion dazu. Auf Grund einiger Besonderheiten wurde die „Mukoide Enteritis“ von der eigentlichen „Dysenterie“ abgegrenzt: „Sie tritt im Gegensatz zu dieser überwiegend bei erwachsenen Kaninchen auf und steht in enger Beziehung zu Fütterungs- und Haltungsfehlern. Charakteristischer Befund ist die bei der Zerlegung festzustellende ausgedehnte mukoide Infiltration der Dickdarmwandungen. … der überwiegende Teil der Fälle wird im Spätherbst und Winter beobachtet und steht in erster Linie mit Fütterungs-, daneben auch mit Haltungsfehlern im Zusammenhang.“
In einer Studie von Chiou & Chang, 19946) wurde der Einfluss von Ballaststoffkomponenten (Cellulose, Pektin, Lignin und Luzerne) u.a. auf die Darmstruktur von 9 Wochen alten Hauskaninchen untersucht. Verschiedene Faserkomponenten beeinflussten die Höhe der Zotten und die Dicke der Muskelschicht des Jejunums und des Dickdarms sowie die Kryptentiefe des Duodenums und des Ileums. REM-Aufnahmen (Rasterelektronenmikroskop) zeigten eine signifikante Schädigung der Zottenoberfläche im Duodenum und Jejunum durch Ligninsupplementierung wie auch signifikante Schädigungen der Schleimhaut bei Cellulose-, Pektin- und Luzernezulagen.
Yu & Peter, 19967) zeigten eindrucksvoll ebenfalls an REM-Aufnahmen, welchen Einfluss die Höhe des Rohfasergehaltes im Futter auf die Morphologie der Darmwand hat. Demnach waren die Darmzotten im Jejunum und Blinddarm bereits bei einem Rohfasergehalt von 14,5% im Futter sichtbar geschädigt.
Guitian und Kollegen berichteten 20008) von der „Mukoiden Enteropathie“ als einer schweren Krankheit des Kaninchens, die in Galizien (NW-Spanien) erstmals in den letzten Monaten des Jahres 1996 und Anfang 1997 beobachtet wurde. In dieser Zeit zeigte die Krankheit einen schweren Verlauf bei 45-50 Tage alten Tieren, wobei schwere Tiere häufiger betroffen waren. Die betroffenen Tiere verloren ihren Appetit und wiesen Schwellungen und schleimigen Durchfall auf, bevor sie starben. Die Merkmale und der Verlauf deckten sich mit Beschreibungen über Ausbrüche dieser Krankheit in Frankreich zu dieser Zeit. In den letzten Monaten 1997 waren die Verläufe weniger akut und von anderen Darmerkrankungen nicht zu unterscheiden. Für ihre Untersuchungen nutzten die Wissenschaftler das Futter und Nachkommen von Tieren aus kommerziellen Betrieben, in denen die Krankheit auftrat und die sie vom Alter von 31-32 Tagen bis zur Schlachtreife aufzogen. Zum Einsatz kamen vier verschiedene Futtersorten, von denen ein Futter keine Antibiotika und Kokzidiostatika enthielt, während die anderen drei nur Kokzidiostatika enthielten. Die Autoren waren nicht in der Lage, das Krankheitssyndrom in ihrer Einrichtung durch das Einbringen von Tieren aus zwei Betrieben, die zuvor die Krankheit gemeldet hatten, und von verschiedenen Arten kommerzieller Pellets zu reproduzieren. Von insgesamt 142 Tieren starben 5 (3,5%) ohne Anzeichen einer Mukoiden Enteropathie. Dazu wurde ausdrücklich angemerkt, dass die Tiere zwar wie in einem kommerziellen Betrieb aufgezogen wurden, sich die Umweltbedingungen zu diesen jedoch aufgrund der sehr guten Hygienepraxis, die während der gesamten Mastperiode angewandt wurde, erheblich unterschieden. Laut den Autoren könnten die Ergebnisse dieser Studie die Hypothese unterstützen, dass die Umwelt und ihre Mikroorganismen eine wichtige Rolle für das Auftreten und/oder die Intensität der Krankheit, sobald sie einmal aufgetreten ist, in kommerziellen Betrieben spielen.
Auf einer Tagung der WRSA ging Licois, 20049) auf den damaligen Forschungsstand zum Thema der Darmerkrankungen beim Kaninchen ein, u. a. auch auf die Kokzidiose und „Kolibazillose“ (Enteropathogenic Escherichia coli (EPEC)) sowie die Epizootic Rabbit Enteropathy (ERE) ein. In Bezug auf ERE wurde auf Forschungsergebnisse verwiesen, die gezeigt hatten, dass eine Futterrestriktion von mindestens -20% der ad-libitum-Menge des Verzehrs der Kontrolltiere zu einer Reduktion der Mortalität und der Morbidität führte. Die Suchen nach enterotropen Viren waren alle negativ (Calicivirus, Pestivirus, Circovirus, Adenovius, Coronavirus und Parvovirus). Folglich wurde zu diesem Zeitpunkt beschlossen, in Ermangelung neuer Kenntnisse die virologische Forschung auszusetzen.
Kühn ging 2005 in einem Übersichtsreferat10), welches auf der 14. Arbeitstagung der DVG in Zusammenarbeit mit der WRSA gehalten wurde, kurz an ausgewählten Beispielen auf die Nomenklatur der Mukoiden Enteropathie ein. Demnach wurde sie anfangs „Enterokolitis“ und später „Mukoide Enteritis“ genannt. Da Anzeichen einer von Entzündungen fehlen, sollte aber von „Mukoider Enteropathie“ gesprochen werden (siehe auch „Allgemeine Definitionen“). Auf einer Zusammenkunft einigten sich Wissenschaftler aus neun betroffen Staaten auf den Begriff „Epizootic Rabbit Enteropathy„ (ERE), der zunehmend für das Krankheitsbild verwendet wird. Übersetzt bedeutet dieser Begriff sinngemäß „das zeitlich und räumlich gehäufte Auftreten einer Darmerkrankung bei Kaninchen“. Für eine Annahme als mögliche Ursache für das gehäufte Auftreten der ERE wurde folgendes vermerkt: „Zunächst wurden Futtermittel für das Auftreten von ERE verantwortlich gemacht, da Fälle von Erkrankungen in zeitlicher Nähe zu vorangegangenen Futterumstellungen standen.“. Diese wurde aber verworfen, u. a. weil:
- sich das Krankheitsbild „weder mit direkt vom Hersteller bezogenen noch mit aus Silos in betroffenen Betrieben entnommenen Futter reproduzieren“ ließ (ohne Quellenangabe)
- „falls ein Bestandteil [des Futters, A. R.] Auslöser der Erkrankung wäre, müsste diese bei ihrem Fehlen in der Ration verschwinden. Dies ist nicht der Fall.“
- „Fabrikationsfehler haben sporadisch zu Darmerkrankungen geführt. … Derartige Einzelfälle können aber kein seuchenhaftes Geschehen erklären, das wie ERE in ganz Europa auftritt“.
Worauf in dem Referat mit keinem einzigen Wort eingegangen wurde ist die Frage, warum es überhaupt zu „vorangegangenen Futterumstellungen“ kam, die offenbar den Europäischen Raum betraf. Die Frage wurde in einem Memo der Europäischen Union beantwortet: “1997 und 1998 wurde fünf Antibiotika die Zulassung entzogen und deren Verwendung in Futtermitteln verboten (Avoparcin, Zink-Bacitracin, Spiramycin, Virginiamycin und Tylosin-Phosphat), um die Resistenz gegen zu therapeutischen Zwecken eingesetzte Antibiotika senken zu helfen.„11)
Verboten wurden die Antibiotika in der Europäischen Union, weil sie zu Arzneimittelverbindungen gehören, die auch in der Humanmedizin eingesetzt werden. Bacitracin und Tylosin wurden z. B. für Kaninchen empfohlen (Licois, 2004). Ab Januar 2006 durfte schließlich auch „Flavophospholipol“, welches bis dahin noch in Kaninchenfutter erlaubt war, nicht mehr eingesetzt werden. Das heißt, im Gegensatz zur Feststellung von Kühn, 2005 könnte durch Futterumstellungen in Europa durchaus auch ein seuchenhaftes Geschehen in Europa ausgelöst werden. Werden in anderen Regionen der Welt ähnliche Entscheidungen getroffen, kann es auch dort zu ähnlichen Erkrankungen kommen (siehe hierzu später bei Rodríguez-De Lara et al., 2008 für Mexiko). Einen geschichtlichen Abriss zum Einsatz von Antibiotika in Tierfuttermitteln liefert eine Übersichtsarbeit von Kirchhelle, 201812).
Ebenfalls auf der 14. Arbeitstagung der DVG im Jahr 2005 stellte G. Rossi Untersuchungsergebnisse vor, die das Vorkommen von E. coli und C. perfringens betrafen. Waren es im Frühjahr 2002 noch 60% der Kaninchenbestände, die mit Darmlähmung (ERE) zu kämpfen hatten, waren zum Winterende 2005 bereits 85% der betreuten Bestände betroffen. Dazu hieß es: „Vormals E. coli-Problembestände senden heute Tiere mit Darmlähmung, assoziiert mit Cl. perfringens. Im Prinzip ist die Darmlähmung nicht auf Bestände beschränkt, die zuvor schon Dysenterieprobleme hatten.“.
Gallois et al., 200713) fanden in einer Untersuchung zum Thema „Enteropathogene Escherichia coli“ (EPEC), dass später entwöhnte Kaninchen (35 Tage im Vergleich zu 21 Tagen) später und nicht so häufig erkrankten und verstarben. Die Mortalitätsrate in der frühen Absetzgruppe betrug 36% und in der später entwöhnten 20%. Bei erkrankten Tieren konnte eine starke Anhaftung (Adhäsion) der Bakterien an die Enterozyten des Darmephitels mit den entsprechenden Läsionen beobachtet werden, wie sie für EPEC typisch sind. Als Symptome wurden Lethargie, Gewichtsverlust, Anorexie und starker, wässriger Durchfall verzeichnet.
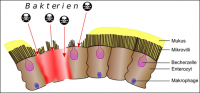 Abb. 1: Sinnbildliche Darstellung der Wirkung pathogener Bakterien und ihrer Gifte auf die Darmwand
Abb. 1: Sinnbildliche Darstellung der Wirkung pathogener Bakterien und ihrer Gifte auf die Darmwand
Rodríguez-De Lara, et al. berichteten 200814) von einer Häufung des Auftretens von Darmerkrankungen bei Kaninchen seit 2001/2002 in verschiedenen Mastbetrieben in Mexiko mit Symptomen, die denen der ERE in Europa ähnelten. Als Ergebnis der eigenen Untersuchungen schrieben die Autoren: “The disease was multifactorial and consisted of sub-acute mucoid enteropathy probably induced by viral infection and aggravated by the proliferation of opportunistic pathogens common to rabbits.„. Eine Infektion mit Rota-Viren wurde trotz negativen Nachweises nicht ausgeschlossen. Hingewiesen wurde auf eine Studie von Nieddu et al., 200015) in der zwischen 1982 und 1999 eine elektronenmikroskopische Studie an Kaninchen mit Enteropathie durchgeführt wurde. Sie fanden in 37% der Fälle unterschiedliche Viruspartikel, so z. B. Rotavirus-ähnliche, Corona-, Parvo- und Enteroviren, außerdem gab es Zufallsfunde von Adeno-, Calici- und Reoviren. Diese Autoren wiesen zudem darauf hin, dass mehr als ein Virus mit schleimiger, hämorrhagischer und nekrotischer Enteritis assoziiert sein könnte. Das Rotavirus wurde von verschiedenen Wissenschaftlern mit ERE in Verbindung gebracht, obwohl es als ein Erreger von mäßiger Pathogenität gelte. Eine hohe Sterblichkeit trete aber dann ein, wenn andere Erreger wie Parasiten und Bakterien mit diesem assoziiert sind. Die niedrigen Gamma-Globulin-Werte bei Kaninchen, die einen Durchfallausbruch überlebten, deuteten auf eine defekte Wirtsabwehr hin, die wahrscheinlich die Folge einer chronischen Krankheit war, aber der Mechanismus, der dabei eine Rolle spielte, ist unbekannt. Die allgemeinen Merkmale des Verlaufs und der Darstellung der Ausbrüche deckten sich mit der Beschreibung der europäischen Ausbrüche der ERE insbesondere im Hinblick auf die Ansteckungsgefahr, die rasche Ausbreitung, der Persistenz, den klinischen Anzeichen, der Pathologie, der Immunsuppression, dem unwirksamen Ansprechen auf Behandlungen und der hohen Mortalität. Für ein besseres Verständnis der spontanen Entwicklung, Pathologie und Pathobiologie der Krankheit wurde u. a. empfohlen, angemessene Programme für das Management, die Immunstimulation, Prophylaxe, Hygiene und Ernährungspraktiken in Betrieben einzuführen, die von der Krankheit betroffen waren. In Mexico durften, bis auf bestimmte Ausnahmen, AGP’s (antibiotic growth promoter = antibiotische Wachstumsförderer = Antibiotika) in Futtermitteln für Tiere ab 2006 nicht mehr eingesetzt werden.
Lavazza et al., 2008Lavazza, A., Cerioli, M., Martella, V., Tittarelli, C., Grilli, G., Brivio, R., & Buonavoglia, C. 2008. Rotavirus in diarrheic rabbits: Prevalence and characterization of strains in Italian farms. In Proc IX World Rabbit Congress. Verona, Italy. pp. 993-998)) untersuchten aus einem Zeitraum von 2002-2007 Proben von 243 Kaninchen, die eine katharrale, hämorrhagische oder nekrotische Entero-Typhlitis (Blinddarmentzündung) und/oder typische Anzeichen von Mukoider Enteropathie und Zäkum-Impaktionen aufwiesen. Die Ergebnisse deuteten darauf hin, dass die meisten Fälle von Kaninchenenteritiden wahrscheinlich mehrere Ätiologien aufweisen. Die Feststellung, dass keine spezifischen Krankheitserreger mit Kaninchenenteropathien in Verbindung gebracht werden können hat zu der Hypothese geführt, dass der „Kaninchenenteritis-Komplex“ ein multifaktorielles Syndrom mit synergetischen Mechanismen ist, die oft die Pathogenität der verschiedenen Mikroorganismen verstärken. Unter den verschiedenen Viren, die bei Kaninchen, die an Enteropathie leiden, gefunden werden konnten, scheint das Rotavirus eine wichtige, wenn auch nicht primäre Rolle zu spielen. Es verursacht Schäden an der Schleimhaut und prädisponiert so die Anheftung und Vermehrung von Bakterien. In diesem Fall ist ein dosisabhängiger Effekt möglich, sowie eine vorübergehende Infektion und eine kurze Ausscheidungsdauer, wodurch der Nachweis von Viren in Verbindung mit E. coli, Clostridium spp, Kokzidien und anderen Protozoen möglich wird. Die Situation der intensiven Kaninchenzucht sei gekennzeichnet durch eine intensive genetische Selektion, übertriebene Produktionsleistungen, zeitweise Überbevölkerung und folglich eine hohe Umweltbelastung mit fakultativen Krankheitserregern. Daher könnten Viren und andere schwach pathogene Erreger (z.B. Flagellaten) eine wichtigere Rolle für das Auftreten schwerer Enteritis beim Kaninchen spielen, indem sie mikrobielle Sekundärinfektionen prädisponieren und verschlimmern. Andererseits könne nicht ausgeschlossen werden, dass die veränderten physiologischen und metabolischen Bedingungen, die durch verschiedene Faktoren, ob ernährungsbedingt oder nicht, die Replikation von Viren verstärken können, so dass sie eine pathogene Wirkung entfalten.
Romero et al., 200916) befassten sich in ihren Untersuchungen mit dem NDF-Gehalt des Kaninchenfutters sowie dem Absetzalter von jungen Kaninchen und deren Einfluss auf die Proliferation von Clostridium perfringens im Blinddarm sowie die Maststerblichkeit bei Zuchtkaninchen, die in einer von ERE betroffenen Anlage gehalten wurden. Ein signifikanter Effekt (P < 0,001) der Wechselwirkung zwischen dem Alter bei der Entwöhnung, der Art des Futters und der Versuchsperiode auf die Clostridium-Gehalte 14 Tage nach der Entwöhnung wurde festgestellt, da Kaninchen, die später entwöhnt wurden, niedrigere Clostridium-Zahlen aufwiesen, insbesondere, wenn sie mit NDF-ärmeren Futter (330 g/kg Futter) gefüttert wurden. Die Ergebnisse deuteten darauf hin, dass hohe Vorkommen von C. perfringens im Verdauungstrakt mit klinischen Symptomen von ERE und Mortalität assoziiert sind. Die Studie klärte jedoch nicht, ob die hohen Vorkommen die Ursache oder die Wirkung waren. Trotzdem wurde eine Begrenzung der NDF in der Nahrung auf etwa 330 g/kg Futter und eine Verlängerung des Zeitraumes bis zum Absetzen der Jungtiere vorgeschlagen, um die Proliferation von Cl. perfringens zu kontrollieren und auch die Mortalität auch unter schlechten hygienischen Bedingungen zu senken.
Der Ergebnisse von Romero et al., 2009 zur verlängerten Säugezeit wurden schon in früheren Arbeiten anhand der Wirkungen der Capryl- und Laurinsäure bestätigt, die in der Kaninchenmilch enthalten sind. Skřivanová & Marounek wiesen 2002 nach, dass die Milch des Kaninchens über einen antimikrobiellen Effekt verfügt und die Sterblichkeit junger Kaninchen senken kann. Im Vergleich zur Kontrollgruppe konnte die Sterblichkeit von 16,7% auf 0% gesenkt werden, wenn 1 kg Futter 5 g Caprylsäure zugemischt wurde. In einem 2. Versuch in einem anderen Betrieb mit dem gleichen Futter sank die Sterblichkeit von 9,3% auf 2%. Skřivanová et al, 200517) ermittelten die Empfindlichkeit von Clostridium perfringens gegenüber C2-C18-Fettsäuren: Laurinsäure wies unter den getesteten Fettsäuren die höchste Aktivität gegenüber C. perfringens auf. Ihre Aktivität wurde nicht durch das Vorhandensein von festen Partikeln beeinflusst und ließ auch bei einem pH-Wert von > 6 nicht nach. Das heißt, die Kaninchenmilch verfügt neben ihrem Nährstoffgehalt auf Grund ihrer Inhaltsstoffe auch über einen protektiven Einfluss auf die Gesundheit wachsender Kaninchen. Werden Jungtiere früh abgesetzt (z. B. nach 4 Wochen), ist dieser Schutz im geringeren Maß vorhanden.
 Abb. 2: Ein junges Wildkaninchen versucht im Alter von ca. 8 Wochen, bei der Mutter noch etwas Milch zu bekommen
Abb. 2: Ein junges Wildkaninchen versucht im Alter von ca. 8 Wochen, bei der Mutter noch etwas Milch zu bekommen
De Blas et al., 201218) schrieben in einer Übersichtsarbeit, dass das Absetzen eine Stressperiode für junge Kaninchen darstellt, die durch abrupte Änderungen der Ernährung und der Umwelt verursacht wird. Ein unreifes Immunsystem zusammen mit einer vorübergehenden Abnahme der Nährstoffverdaulichkeit bringe das Tier in ungünstige Bedingungen, in denen Verdauungspathologien auftreten können. Zudem hatte in den letzten Jahren das europäische Verbot von antibiotischen Wachstumsförderern in Tierfuttermitteln das Entwöhnungsmanagement für Landwirte wegen der weit verbreiteten und häufigen neu auftretenden Tierkrankheiten sogar erschwert. Obwohl die Ätiologie dieser Krankheit noch unbekannt sei, könne die Verbreitung von Clostridium perfringens eine Folge der ERE sein und mit der hohen Sterblichkeit durch diese Krankheit in Verbindung gebracht werden. Obwohl sich mehrere Antibiotika gegen ERE als wirksam erwiesen hätten, müssten alternative Lösungen zur Bekämpfung der Krankheit gefunden werden, um die geltende EU-Gesetzgebung zu erfüllen. Anhand von unglaublich vielen Quellen wurde auf verschiedene Punkte eingegangen, die Darmerkrankungen verursachen. Da Antibiotika in Futtermitteln „umstritten“ seien, wurde das Augenmerk auf einen optimalen Level der löslichen Fasern gelenkt (Fruktane, Galaktane, ß-Glucane, Pektine). Als weiterer wichtiger Punkt wurden Aminosäuren erwähnt, die u. a. der Erneuerung und dem Wachstum der Darmschleimhaut dienen. Dem Züchter nützen solche Informationen natürlich nur wenig, weil er sie mit seinem Futter nicht mitgeliefert bekommt. Eine späte Entwöhnung würde auch eine bessere Anpassung der Verdauungs- und Absorptionsfähigkeit junger Kaninchen an die Aufnahme von festem Futter bedeuten, da sowohl die Amylase- als auch die Disaccharidaseaktivität mit dem Alter zunimmt, aber von 25 bis 35 Tagen niedrig bleibt. Infolgedessen steigt der Stärkefluss, der das Ileum bei jungen Kaninchen erreicht, mit dem Stärkegehalt im Futter an, was mit einer höheren Sporulation und Enterotoxinproduktion durch C. perfringens und mit einer höheren Durchfallhäufigkeit in der Mastzeit in Verbindung gebracht wurde. Ergebnisse aus anderen Studien deuteten auf eine Übertragung der Immunkompetenz auf die jungen Kaninchen durch die Milch oder die Plazenta der Muttertiere hin. Zudem schienen Ergebnisse aus Untersuchungen die Existenz einer Beziehung zwischen Umwelt, der Verbreitung von C. perfringens im Darm und der Inzidenz des ERE zu bestätigen.
Bäuerl et al., 201419) untersuchten Unterschiede der Blinddarm-Bakterienkultur von gesunden Tieren, die unbehandelt und mit Antibiotika versorgt wurden im Vergleich zu Tieren, die an ERE erkrankt waren. Die gewonnenen Daten untermauerten die These, dass die ERE-Morbidität und -mortalität möglicherweise durch eine Übersiedelung des Darms von Tieren mit verschiedenen Krankheitserregern verursacht wird, deren Immunabwehrsystem nicht ausreichend zu reagieren scheint.
Von einem Autorenkollektiv um Djukovic, A. wurde 201820) der Fund einer neuen Bakterienspezies Clostridium OTU172 bei erkrankten Kaninchen vermeldet, die „Clostridium cuniculi“ genannt wurde. Die identifizierte Spezies produziert mehrere mutmaßliche Toxine und ist phylogenetisch mit den beiden gut charakterisierten Pathogenen Clostridium botulinum und Clostridium perfringens verwandt, was die Autoren eher auf einen infektiösen als auf einen dysbiosebedingten Ursprung der ERE schließen ließ. Allerdings schlugen Versuche fehl, ERE mit einer Übertragung des Clostridium OTU172 auf gesunde Tiere zu reproduzieren.
Gidenne et al., 202021) gingen schließlich in der neuesten Ausgabe von „Nutrition of the rabbit“ auch auf verschiedene Aspekte der ERE ein. Demnach sei die Diagnose von Darmerkrankungen schwierig, da unabhängig von der Ursache (Ernährungsprobleme oder ein spezifischer Erreger) die Symptome und Läsionen im Allgemeinen ähnlich sind. Die Schwierigkeit, die Ätiologie von Darmerkrankungen beim Kaninchen zu erkennen, würde durch die Tatsache verstärkt, dass wie bei den meisten mehrere Faktoren an deren Entstehung beteiligt sind:
- der Status des Tieres selbst (Alter, Genetik, Immunität).
- beteiligte Krankheitserreger (Parasiten, Bakterien, Viren).
- Umweltfaktoren, darunter Ernährungs- und Fütterungsfaktoren, Zuchtbedingungen wie Hygiene, Stress usw.
In der folgenden Abbildung 3 sind einige Informationen über verschiedene Darmerkrankungen zusammengefasst.
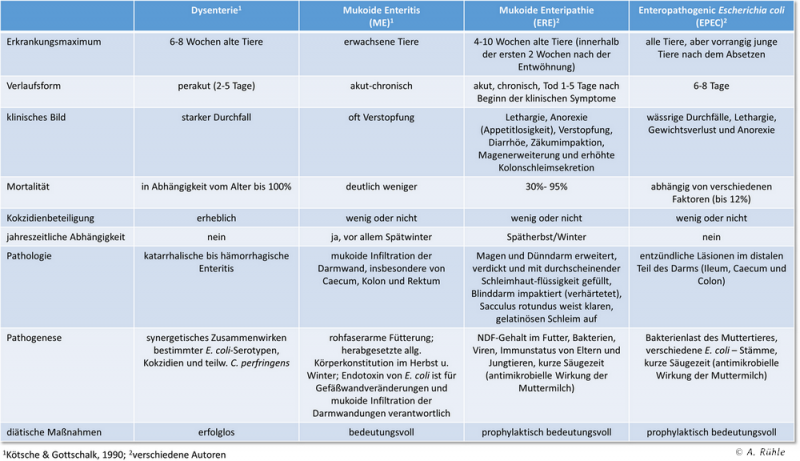 Abb. 3: Beschreibungen verschiedener Darmkrankheiten bei Kaninchen
Abb. 3: Beschreibungen verschiedener Darmkrankheiten bei Kaninchen
Weitere Fakten
Geboren werden junge Wildkaninchen in einer Erdröhre, die normalerweise abseits des Hauptbaus einer Kaninchengruppe liegt. Die Temperatur und Luftfeuchtigkeit in dieser, auch „Satzröhre“ genannten Geburtsstätte ist immer relativ gleich, die einzigen Störungen sind die ein- bis zweimaligen Besuche am Tag durch die Mutter zum Säugen. Die Satzröhre wird weitgehend „keimfrei“ gehalten, die Mutter uriniert dort nicht und hinterlässt nur gelegentlich Hartkotbällchen, die von den Jungtieren beknabbert werden. Nach ca. 14 Tagen verlassen sie das Nest und nach 3-4 Wochen den Bau. Nach dem Fressen von Nestmaterial finden sie hier die natürliche Nahrung, die sie auf Grund der Erfahrung aus Inhaltsstoffen der Muttermilch bereits „kennen“. Ebenso sind ihnen die Bakterien der Mutter bekannt, die ihrerseits jene beherbergt, die von den anderen Tieren der Gruppe stammen. Die Krankheit, die unter Jungtieren von Wildkaninchen die größten Verluste verursacht, ist die Kokzidiose, welche vorrangig von der Nahrungsverfügbarkeit und Witterungsfaktoren abhängig ist.
Demgegenüber wachsen Hauskaninchen in der Regel in „Nestboxen“ auf, die im Stall des Muttertieres untergebracht sind und werden nach der Entwöhnung mit einem Standardfuttermittel ernährt. In der folgenden Tabelle sind grundsätzliche Unterschiede im Aufwachsen von Wild- und Hauskaninchen aufgeführt. Bei Letzteren gibt es sicher Unterschiede zwischen Mast- und Zuchtbedingungen, weshalb sie sehr allgemein formuliert sind.
Abbildung 4: Vergleich der Bedingungen, unter denen Wild- und Hauskaninchen aufwachsen
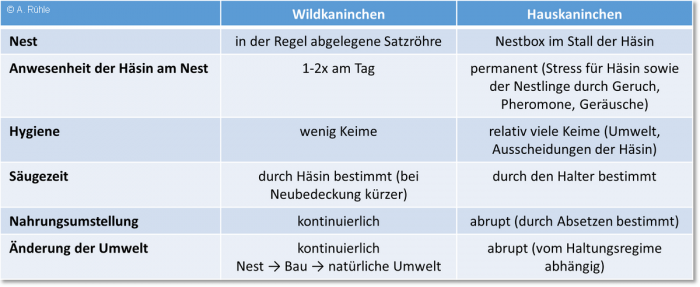 Abb. 4: Vergleich der Bedingungen, unter denen Wild- und Hauskaninchen aufwachsen
Abb. 4: Vergleich der Bedingungen, unter denen Wild- und Hauskaninchen aufwachsen
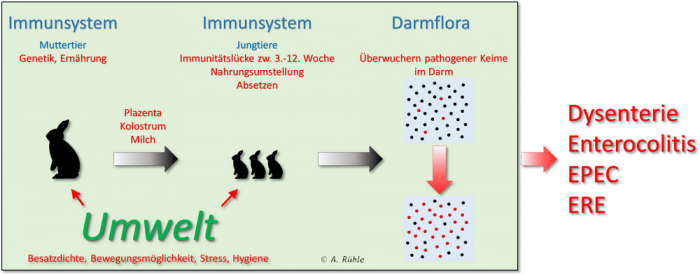 Abb. 5: Zusammenhang zwischen Muttertier und Jungkaninchen in Bezug auf die Entwicklung des Immunsystems und der Darmflora
Abb. 5: Zusammenhang zwischen Muttertier und Jungkaninchen in Bezug auf die Entwicklung des Immunsystems und der Darmflora
Fasst man die Informationen der angeführten Fachartikel zusammen, ergeben sich verschiedene Einflüsse, die zu Darmerkrankungen führen können.
Abbildung 6: Mögliche Einflüsse auf das Entstehen von Darmerkrankungen. In der Hauptsache wird durch verschiedene Faktoren das Immunsystem geschwächt, was eine Vermehrung pathogener Keime begünstigt
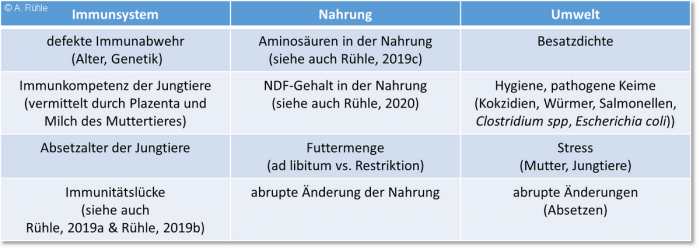 Abb. 6: Vergleich der Bedingungen, unter denen Wild- und Hauskaninchen aufwachsen
Abb. 6: Vergleich der Bedingungen, unter denen Wild- und Hauskaninchen aufwachsen
Häufig sind es mehrerer Faktoren, die eine Erkrankung auslösen. Deshalb wird die Ätiologie solcher Krankheiten auch „multifaktoriell“ genannt, das heißt, es sind in der Regel mehrere dieser Faktoren, die zu einem Krankheitsbild führen. In einem lebenden Organismus kommen mögliche Synergieeffekte hinzu. Das heißt, dass sich z. B. die Wirkung von zwei Faktoren nicht einfach zu einer Summe addiert, sondern das sich ein Effekt potenziert. Dann ist in der Regel von „sprunghaft“ die Rede. Viele pathogene Keime sind z. B. als sogenannte „Passanten“ auch in gesunden Tieren unterwegs. Erst ein weiterer Faktor führt zu einer sprunghaften Vermehrung pathogener Keime, die zu einer Erkrankung führt, die das Immunsystem des Wirtes nicht mehr kontrollieren kann.
Trockenfutter
Zur Bekämpfung der Krankheiten gibt einerseits den Ansatz, „stallspezifische“ Impfstoffe einzusetzen. Das ist kostenintensiv und dient eigentlich nur der Eindämmung von Symptomen, die durch pathogene Bakterien hervorgerufen werden. An der Ursache hat man damit noch nichts geändert. Entsprechend ist der Weg der Futtermittelindustrie wahrscheinlich eher zielführend, den Futtermitteln als Ersatz für Antibiotika phytogene Zusatzstoffe zuzumischen, die über eine antibakterielle Wirkung verfügen. Eine ähnliche Verfahrensweise wurde bereits zur Bekämpfung von Durchfallerkrankungen mittels phytogener Zusätze untersucht, so z. B. von Krieg et al., 2005 und Krieg et al., 2007. Zu solchen Untersuchungen muss folgendes angemerkt werden:
- finden sie nur über einen begrenzten Zeitraum statt, das heißt, die Muttertiere erhielten die neuen Futtermittel erst kurz vor den Versuchen (Konditionierung).
- können neue Komponenten im Futter zunächst zu einer verringerten Futteraufnahme führen,
- fehlen als Vergleich Wildkaninchen unter gleichen Umgebungsbedingungen, aber mit ihrer natürlichen Nahrung.
Als ein Beispiel für die Beeinflussung der Darmgesundheit (und somit auch des Immunsystems) soll eine Untersuchung von Krieg et al., 200522) dienen. Mit den Untersuchungen sollte gezeigt werden: “dass phytogene Aromastoffe nicht nur eine bedeutende Rolle im antibiotikafreien Fütterungs-Management haben, sondern auch als eine unabhängige Art von Futterzusatz dienen, die für Tier, Mensch und Umwelt nützlich sind.„. Zu diesem Zweck wurden einer Gruppe mit Muttertieren ab dem 29. Trächtigkeitstag und ihren Nachkommen nach dem Absetzen am 28. Tag ein Futter ohne Zusätze verfüttert (Kontrollgruppe). 5 andere Gruppen erhielten nach der gleichen Vorgehensweise jeweils ein Futter mit bis zu 15 verschiedenen „Aromen“. Als ein Parameter wurden die Verluste erfasst (siehe Abbildung 7).
Abbildung 7: Verluste durch Einsatz verschiedener, phytogener Zusatzstoffe nach dem Absetzen (n=40 Tiere/Gruppe); nach Daten aus Krieg et al., 2005
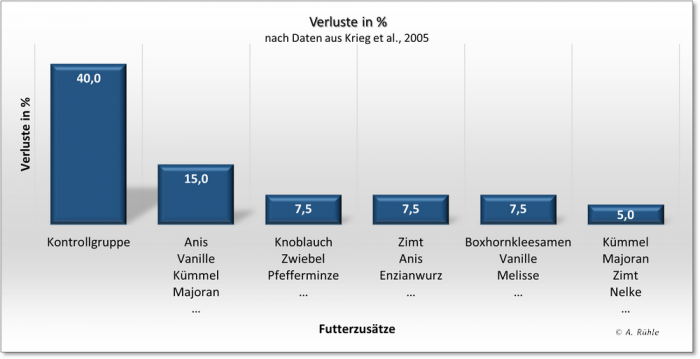 Abb. 7: rabbit_phytogene_Krieg.png
Abb. 7: rabbit_phytogene_Krieg.png
Die Verringerung der Verluste um bis zu 35% (von 40% auf 5% in der 5. Gruppe) ist ganz erstaunlich, wenn man bedenkt, dass sie „nur“ durch den Zusatz von phytogenen (pflanzlichen) Inhaltsstoffen verursacht wurde – also durch Stoffe, über die Wildkaninchen in ihrer täglichen Nahrung verfügen. Auf ganz ähnliche Weise verringerte sich auch das Durchfallgeschehen in den Gruppen. Damit soll exemplarisch gezeigt werden, wie durch die Änderung nur eines Faktors in der Kaninchenhaltung die Gesundheit der Tiere beeinflusst werden kann. Viele Züchter wissen natürlich um den Nutzen des Einsatzes verschiedener Kräuter in der Kaninchenfütterung, der sich noch verstärkt, wenn sie ihnen in natürlicher Weise angeboten werden (Wassergehalt, Struktur, Kohlenhydrate, Sekundäre Pflanzenstoffe, Aufnahme- und Kauzeit, Darmperistaltik etc.). Arbeiten wie die von Krieg et al., 2005 bestätigen eigentlich nur das „alte“ Wissen.
In einem weiteren Versuch von Krieg et al., 200723) mit einem „standardisierten“, mit „Aromen“ angereicherten Futtermittel zeigte sich ein Einfluss auf das Verhältnis der Fettsäuren und somit den pH-Wert im Blinddarm. Während es in der Kontrollgruppe zu einem Anteil von Verstopfungen von 27,5% kam, war dies in der Versuchsgruppe „nur“ bei 5% der Tiere der Fall.
Natürliche Nahrung
Die Zusatzstoffe in Trockenfuttermitteln können dem Kaninchen auch in natürlicher Form über die arttypische Nahrung zur Verfügung gestellt werden. Diese hat, neben der Wirkung der enthaltenen Nähr- und Wirkstsoffe, für Hauskaninchen den gleichen Nutzen wie für die wilden Artgenossen. Für diese spielen Darmerkrankungen, bis auf die parasitär verursachte Kokzidioese, keine bedeutende Rolle.
3 2 311
